Autor: Dr. Aberlardo Bárez García
El TASPE es considerado el standard of care en pacientes con MM elegibles a tal procedimiento.
La presencia de anomalías citogenéticas de alto riesgo se asocia a una menor duración de las respuestas; y la frecuencia de aberraciones genéticas específicas, como la t(4:14), es mayor en los pacientes más jóvenes elegibles para trasplante que en los pacientes ancianos.
Los pacientes con MM con la t(4;14) (p16;q32) tienen una mediana de tiempo a progresión de 2 años, con una mediana de supervivencia de 5. Estos pacientes deben ser tratados inicialmente con un régimen basado en bortezomib y, posteriormente, realizar un trasplante si es posible.
El consenso del International Myeloma Working Group recomienda realizar un doble trasplante en estos casos.(1) El estudio EMN02/HO95 demostró un beneficio en supervivencia libre de progresión (SLP) y supervivencia global (SG) con el doble trasplante, sobre todo en pacientes con citogenética de alto riesgo.(2)
El estudio ASPIRE demostró que la adición de carfilzomib a lenalidomida y dexametasona mejora de forma significativa la SLP,(3) independientemente de si el paciente ha recibido previamente o no bortezomib. Posteriormente, también ha demostrado beneficio en la SG.(4)
En los estudios ASPIRE y ENDEAVOR, los tratamientos basados en carfilzomib han demostrado una gran eficacia, tanto en los pacientes que han recibido un trasplante como en los que no lo han recibido.(5)
Un análisis de subgrupos del estudio ASPIRE planificado a priori demostró que KRd tiene un perfil de beneficio-riesgo favorable en comparación con Rd (lenalidomida/dexametasona), independientemente del estado de riesgo citogenético inicial. KRd mejora pero no elimina el mal pronóstico asociado a la citogenética de alto riesgo en pacientes con MM en recaída.(6)
Concretamente, en los pacientes que presentaban la t(4;14), la mediana de SLP fue de 23,1 meses y la ratio de respuestas totales del 80 % (comparado con 16,7 meses y 72 %, respectivamente, en el brazo de lenalidomida y dexametasona).(6)
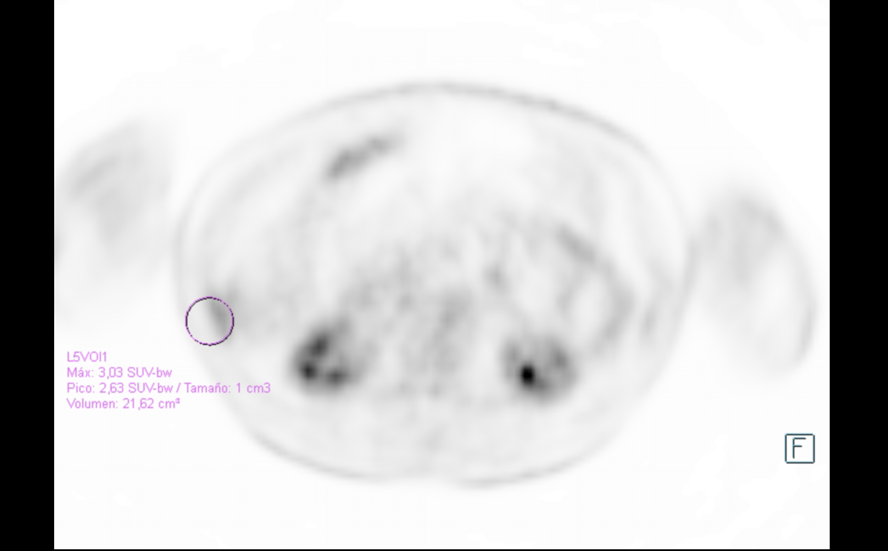
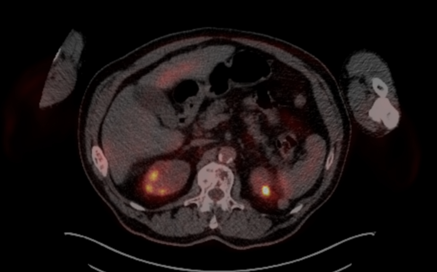
En este caso, que presentaba la t(4;14), la respuesta fue buena a un esquema basado en bortezomib, pero la duración de la respuesta después del trasplante en tándem fue corta, como está descrito en la literatura en este tipo de mielomas. Por otra parte, era previsible al persistir enfermedad residual por PET-TAC postrasplante.
Una vez iniciado el tratamiento de la recaída, el tratamiento con un esquema basado en un inhibidor de proteosoma (IP), que es lo recomendado en citogenética de alto riesgo, de nuevo la respuesta ha sido muy buena y rápida, a pesar de haber recibido previamente el paciente un esquema con bortezomib y, posteriormente, un doble trasplante.
Comentario del experto: Dra. Marta Sonia González Perez
Se trata de un paciente joven con un MM activo (anemia y lesiones líticas) de alto riesgo citogenético que alcanzó RPMB tras una inducción estándar con 6 ciclos de VTd y RCs EMR negativa medular (EMR positiva por imagen) tras trasplante en tándem.
Una publicación retrospectiva ha mostrado el beneficio en SLP y SG del TASPE en tándem en los pacientes de alto riesgo. Esto ha sido ratificado por un ensayo prospectivo europeo (EMN); sin embargo, otro ensayo prospectivo americano (Stamina) no ha encontrado beneficio frente a 1 TASPE y mantenimiento.
Este paciente no recibió ninguna terapia de mantenimiento, lo que sería recomendable en el momento actual. El único fármaco con esta indicación aprobada es lenalidomida en pauta continua hasta progresión. En los pacientes de alto riesgo citogenético se objetivan resultados menos favorables con esta estrategia que en los de riesgo estándar. Muchos grupos recomiendan añadir un IP al esquema (recomendación no basada en estudios prospectivos randomizados).
El paciente recae 22 meses después del TASPE en tándem presentando una recaída biológica. Se decide terapia de 2a línea 6 meses más tarde por patrón de evolución, dado que es un paciente de alto riesgo. Aunque no está claro cuándo se debe empezar el tratamiento de 2a línea, diversas publicaciones recientes recomiendan el tratamiento precoz, en fase de recaída biológica, sobre todo en pacientes de alto riesgo y/o con enfermedad agresiva al diagnóstico.
En cuanto a la terapia de 2a línea elegida, se trata de un paciente con t(4;14) previamente expuesto a bortezomib y talidomida, no refractario a ninguno de los dos fármacos y que alcanzó una respuesta adecuada con la combinación. En este caso, la terapia con un triplete basado en IP + IMiDs, como KRd, se ha mostrado eficaz, con una SLP esperable en torno a 2 años. El antecedente de HTA no debe ser considerado como una contraindicación para el tratamiento con carfilzomib. Es recomendable el ajuste del tratamiento anti-HTA previamente y durante el tratamiento.