Autor: Dr. Fernando Martín Moro
El tratamiento con KRd proporciona respuestas profundas y mantenidas en el tiempo,(2) si bien a día de hoy la duración óptima de la terapia no está establecida. Parece que los tratamientos más prolongados llevan a una profundización de la respuesta en el tiempo, sin embargo, en ocasiones los efectos adversos obligan a la discontinuación.
Se debe valorar de forma individualizada para cada paciente la posibilidad de mantener KRd a partir de los 18 ciclos de tratamiento, atendiendo al estado de la enfermedad y a los efectos adversos de la terapia.(4)
Comentario del experto: Dra. Marta Sonia González Perez
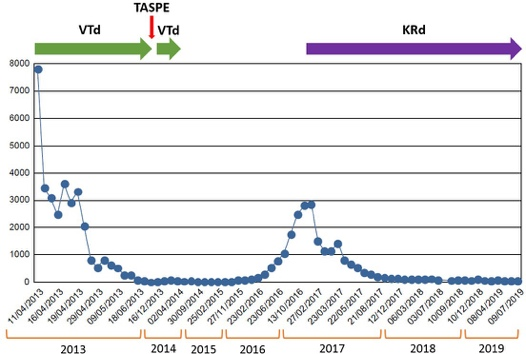
Se trata de un paciente, aparentemente sin comorbilidad, diagnosticado de un MM IgG lambda con proteinuria de BJ ISS III de riesgo citogenético estándar que recibe una terapia de inducción estándar con 6 ciclos VTd alcanzando RPMB, y un TASPE alcanzando RCs con EMR positiva que se negativiza tras 2 ciclos de consolidación. Este paciente no recibe tratamiento posterior. En el momento actual, la recomendación estándar sería un tratamiento de mantenimiento con lenalidomida hasta la progresión.
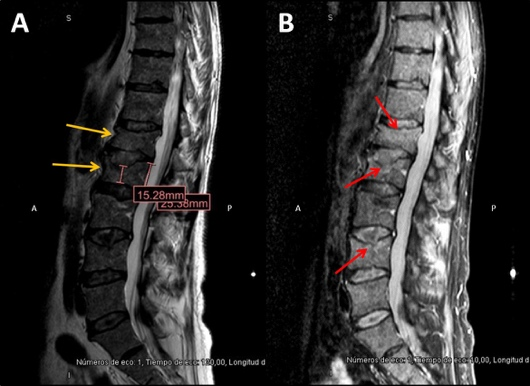
El paciente presenta recaída bioquímica a los 28 meses tras TASPE, con recaída sintomática 11 meses más tarde por insuficiencia renal.
No existen recomendaciones claras sobre el beneficio del tratamiento precoz en la recaída bioquímica frente a la espera de una recaída sintomática. Algunos autores sugieren un tratamiento precoz en pacientes de alto riesgo o que hayan debutado con enfermedad agresiva al diagnóstico. En este paciente con insuficiencia renal expuesto a bortezomib y talidomida previos, sensible a ambos fármacos y con una recaída tardía, se elige como terapia de segunda línea KRd. La respuesta ha sido excelente, alcanzando RCs tras los 18 ciclos de inducción, con EMR positiva. A diferencia del ensayo ASPIRE, se decidió continuar con el triplete hasta progresión, con la hipótesis de conseguir una supervivencia libre de progresión más prolongada. Tras 30 ciclos, se consiguió EMR negativa sin evidencia de toxicidad significativa en relación con carfilzomib.
Llama la atención la toxicidad severa que el paciente presentó con lenalidomida: se observó eritrodermia (toxicidad grado IV), 2a neoplasia primaria (carcinoma epidermoide) y TVP. Una posible alternativa hubiese consistido en suspender lenalidomida y mantener carfilzomib + dexametasona hasta progresión.