Paciente de 65 años y sin antecedentes personales de interés, que es remitido por su médico de atención primaria en abril de 2009 tras hallazgo en analítica de rutina de componente monoclonal (CM) IgG kappa.
Se encontraba asintomático, sin daño orgánico asociado, anemia, fracaso renal o hipercalcemia. Solo se detecta osteopenia en serie ósea.
A nivel analítico destacaba: IgG 3.490 mg/dl, IgA 114 mg/dl, IgM 53,9 mg/dl, cadena ligera kappa
1.120 mg/dl, cadena ligera lambda: 39 mg/dl.
CM: 31,2 % (1.088,88 mg/dl).
Inmunofluorescencia indirecta: IgG kappa.
Beta-2-microglobulina: 1,7 (normal).
Proteinograma en orina: proteinuria Bence-Jones (BJ).
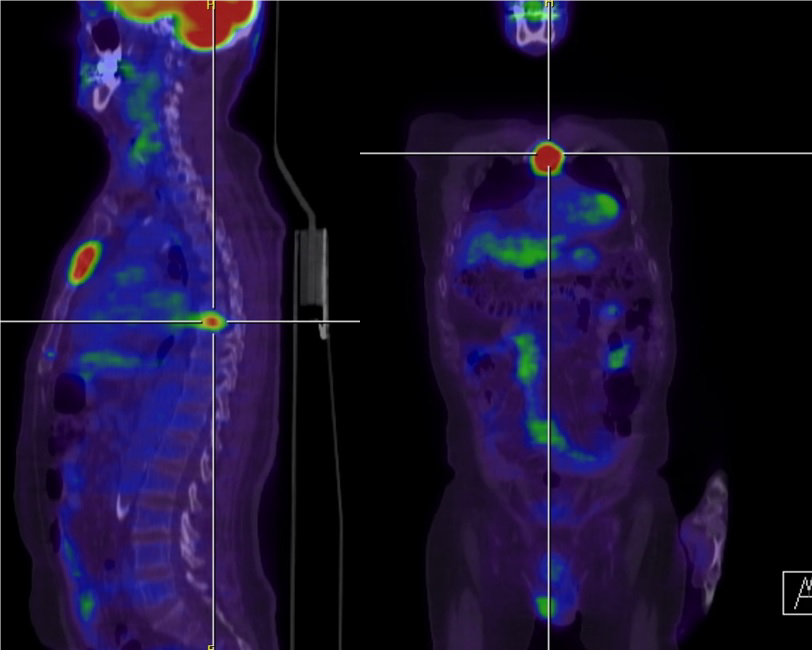
En la biopsia de médula ósea: aspirado medular con infiltración intersticial por células plasmáticas atípicas (entre 10 % - 12 %) que reuniría criterio menor para mieloma múltiple (MM) (10 % de células plasmáticas aberrantes con sobreexpresión de CD56 y CD117 a nivel de CMF).
Por todo ello, el paciente es diagnosticado de MM quiescente IgG kappa, con mínima proteinuria BJ, estadio ISS II, por lo que no precisó inicio de tratamiento.
En el año 2016, se objetiva anemización (Hb 10,9 g/dl e incremento progresivo del CM [IgG 5950 mg/dl], ratio cadenas ligeras libres 65,05 y dCLL 698,1, proteinuria BJ estable), por lo que se realiza reevaluación del paciente.